Neuron | 厦门大学张亮团队揭示少突胶质细胞分化和髓鞘形成所必需的核孔蛋白
爱默基因有幸共同参与了该课题的研究,为该项目的推进提供了些许助力;爱默基因技术总监梁耀极博士作为文章的共同第一作者参与了该论文的发表,主要在RNA-SEQ、CHIP-SEQ和ATAC-SEQ等二代测序相关技术在本课题中的应用上做出了相关贡献。

Summary
Nucleoporins (Nups) are involved in neural development, and alterations in Nup genes are linked to human neurological diseases. However, physiological functions of specific Nups and the underlying mechanisms involved in these processes remain elusive. Here, we show that tissue-specific depletion of the nucleoporin Seh1 causes dramatic myelination defects in the CNS. Although proliferation is not altered in Seh1-deficient oligodendrocyte progenitor cells (OPCs), they fail to differentiate into mature oligodendrocytes, which impairs myelin production and remyelination after demyelinating injury. Genome-wide analyses show that Seh1 regulates a core myelinogenic regulatory network and establishes an accessible chromatin landscape. Mechanistically, Seh1 regulates OPCs differentiation by assembling Olig2 and Brd7 into a transcription complex at nuclear periphery. Together, our results reveal that Seh1 is required for oligodendrocyte differentiation and myelination by promoting assembly of an Olig2-dependent transcription complex and define a nucleoporin as a key player in the CNS.
Graphical Abstract
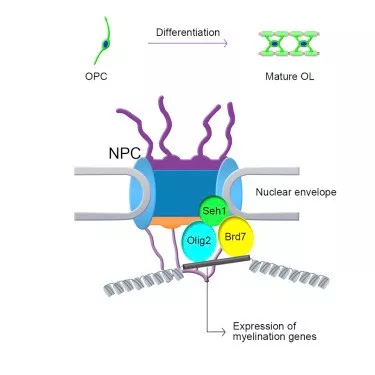
CNS中,少突胶质细胞形成髓鞘以包裹轴突并促进动作电位的快速传播和适当的CNS功能。 少突胶质细胞的髓鞘形成缺陷会破坏致命的神经传导和认知或运动功能,这会导致神经系统疾病,如多发性硬化和脑白质营养不良。 少突胶质细胞祖细胞(OPCs)在多发性硬化患者的脱髓鞘区域中含量丰富; 然而,它们未能分化成成熟的少突胶质细胞。 这种分化过程伴随着大规模的核重组和基因表达的改变。 这些过程依赖于转录因子网络,染色质修饰因子和信号传导途径的精确控制。
作为核孔复合物(NPC)的组分,核孔蛋白(Nups)已被证明在细胞类型特异性转录调节中发挥重要作用。 长期以来,通过电子显微镜观察到,退化的染色质包围着NPC。 最近的研究结果表明,活跃的转录发生在NPC,Nups在这个过程中发挥作用。 Nups可分为核心支架,中央通道,外周和跨膜Nups。 已经发现外周和跨膜Nups,例如Nup153,Nup98和Nup210,通过与转录因子如sox2,mef2c等相互作用直接调节基因表达。 然而,目前尚不清楚核心支架Nups是否参与发育基因调控。
在这里,研究人员显示核孔蛋白Seh1在少突细胞谱系中的组织特异性敲除导致CNS中显著的髓鞘形成缺陷。尽管在缺乏Seh1的少突胶质细胞祖细胞(OPCs)中增殖没有改变,但它们不能分化成成熟的少突胶质细胞,这会损害脱髓鞘损伤后的髓鞘生成和髓鞘再生。全基因组分析显示Seh1调节核心髓鞘形成调节网络并建立可接近的染色质景观。在机制上,Seh1通过将Olig2和Brd7组装成核周边的转录复合物来调节OPCs分化。总之,该结果揭示了Seh1是少突胶质细胞分化和髓鞘形成所必需的,通过促进Olig2依赖性转录复合物的组装并将核孔蛋白定义为CNS中的关键参与者。


