外泌体整体解决方案
外泌体的“个人档案”
外泌体(Exosomes)是来自细胞内通过多囊泡体与质膜融合后释放到胞外的具有磷脂双分子层结构的纳米级囊泡(Extracellular Vesicles,EVs),直径 30 ~ 200 nm,有双层膜结构和茶托状形态,广泛分布于血液、尿液、脑脊液、唾液、乳汁、胆汁等各种体液中。已知将近25%的人类蛋白质是通过外泌体分泌的[1]。
每一种细胞都可以分泌外泌体,不过类型不同的细胞分泌的外泌体在数量上还是在组成上都具有很大的差异性,这也决定了每种外泌体所行使的功能不一样。下面列举一下外泌体的功能:
1.外泌体携带了参与细胞内信号转导的蛋白、miRNA、lncRNA、circRNA、mRNA以及其降解片段,参与细胞活动的重要调控。众多的研究表明,细胞分泌的外泌体具有调节免疫、促进细胞增殖分化、促进骨及血管再生的作用 [2] ;
2.外泌体具有抗原递呈、免疫逃逸、诱导正常细胞转化、促进肿瘤发生和转移等作用;
3.外泌体还可以作为“天然的纳米粒子”来进行药物递送。
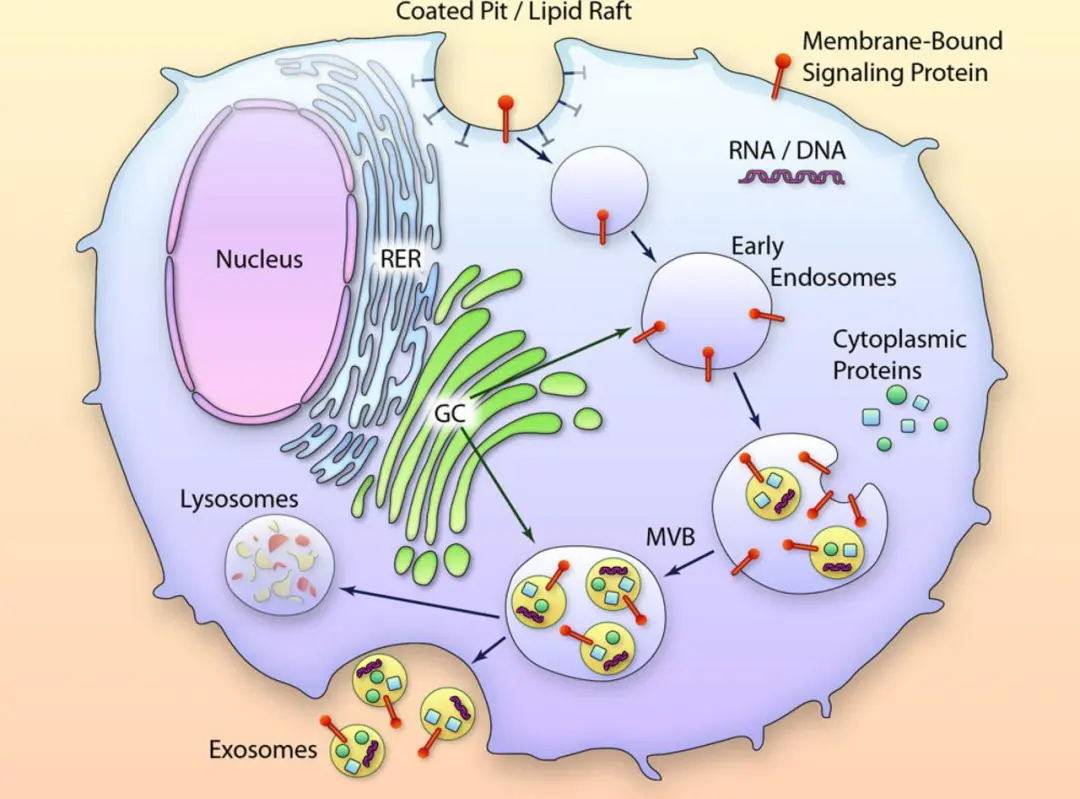
外泌体携带了参与细胞内信号转导的蛋白、miRNA、lncRNA、circRNA、mRNA以及其降解片段,参与细胞活动的重要调控。
必不可少的外泌体研究相关数据库
1. exoRBase
exoRBase[1]收集人血外泌体中的环状RNA(circRNA),长非编码RNA(lncRNA)和信使RNA(mRNA)等大RNA类型的数据。提供注释,表达水平和可能的原始组织。exoRBase将帮助研究人员识别血液外泌体中的分子标记,并将触发新的循环生物标志物发现和对人类疾病的功能暗示。exoRBase基于标准化的RNA-seq数据(涵盖正常人和患有不同疾病的患者)基于RNA表达谱进行整合和可视化。
2. ExoCarta
ExoCarta[3]包含来自286项外泌体研究的41,860种蛋白质,超过7,540种RNA和1,116种脂质分子,这些研究结果均由国际细胞外囊泡学会(International Society for Extracellular Vesicles)注释,使用这些结果定义鉴别细胞外囊泡的最低实验要求。ExoCarta同时包含动态的蛋白质相互作用网络和外泌体蛋白的生物学通路。
3. 还有很多其他优秀的外泌体数据库,由于篇幅限制,这里不一一详细介绍,只讲数据库名称罗列出来:Vesiclepedia,exorbase,exrna-atlas,EVmiRNA,ExoBCD等。
外泌体全转录组分析方案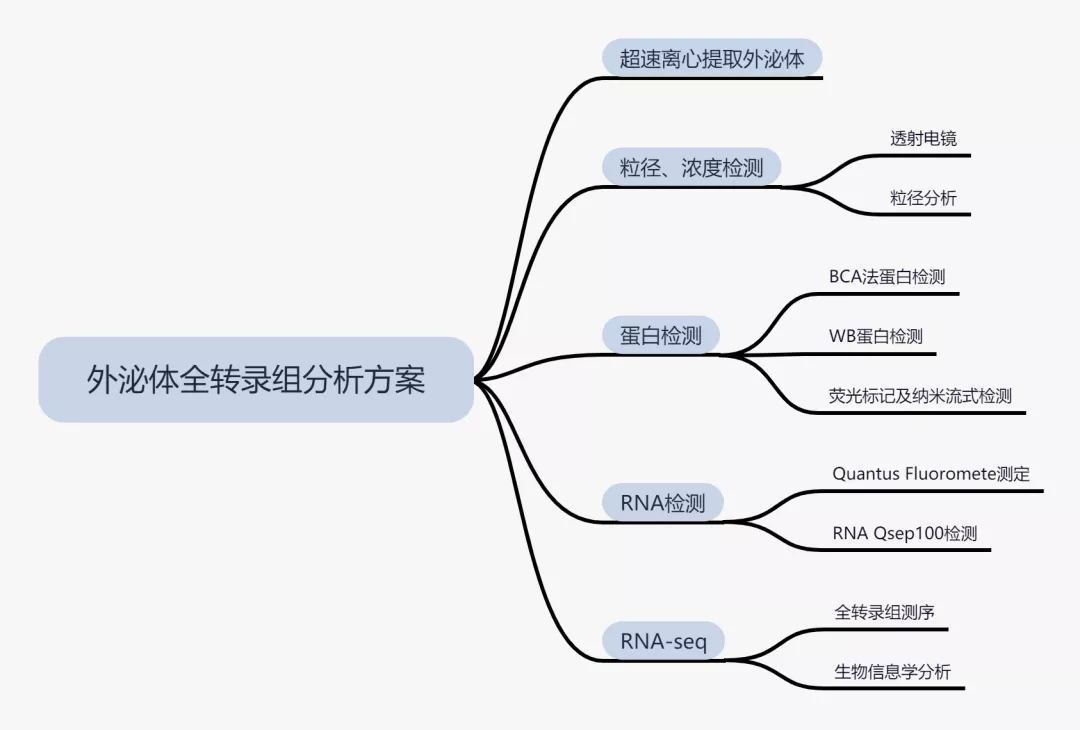
目前,外泌体在肿瘤转移、免疫调控机制、疾病发生发展、阿兹海默症和免疫疾病等疑难杂症的治疗方面崭露头角,有望成为多种疾病的早期诊断标志物。因此,我们针对外泌体设计了一套外泌体全转录组分析方案。
采用超速离心法提取外泌体,并对提取的外泌体进行电镜、粒径、WB检测、纳米流式荧光检测、RNA提取及Qsep100检测。最后对提取出的RNA进行测序并分析。
提取与检测
外泌体的分离方法主要有:差速离心、密度梯度离心、体积排阻色谱法、过滤法、聚合物沉淀法、免疫分离、隔离筛选法等。
但是CNS上外泌体研究的文献中主流的分离方法目前还是超速离心的方法。超速离心分离可以准确地重复获取外泌体,同时最大限度减少蛋白质聚集体和其他膜粒子的共纯化。
外泌体提取过程使用最高转速100000 rpm的CP100MX离心机提取,此离心机落地式超离,离心力大,分离所需时间短。
目前我司对于外泌体的鉴定方法主要有:透射电子显微镜(TEM)、粒径分析(NTA或NanoFCM)、蛋白指标检测(Western Blot或NanoFCM)
以下基于高质量样品经过超速离心提取后
进行质量检测
透射电镜
高质量样品经超速离心提取后,使用透射电镜观察(上图一),并与文献[4]中透射电镜图片(上图二)进行对比WB检测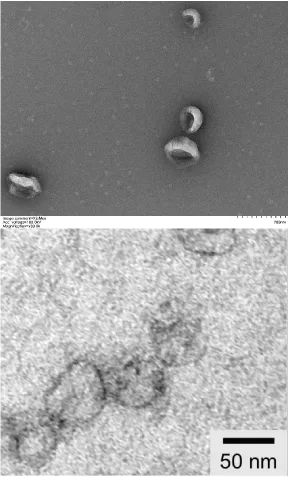
下图左为高质量样品的WB蛋白检测结果:对TSG101、CD63、CD81、CD9四种蛋白进行测定,并添加内质网中的Calnexin蛋白为阴性对照。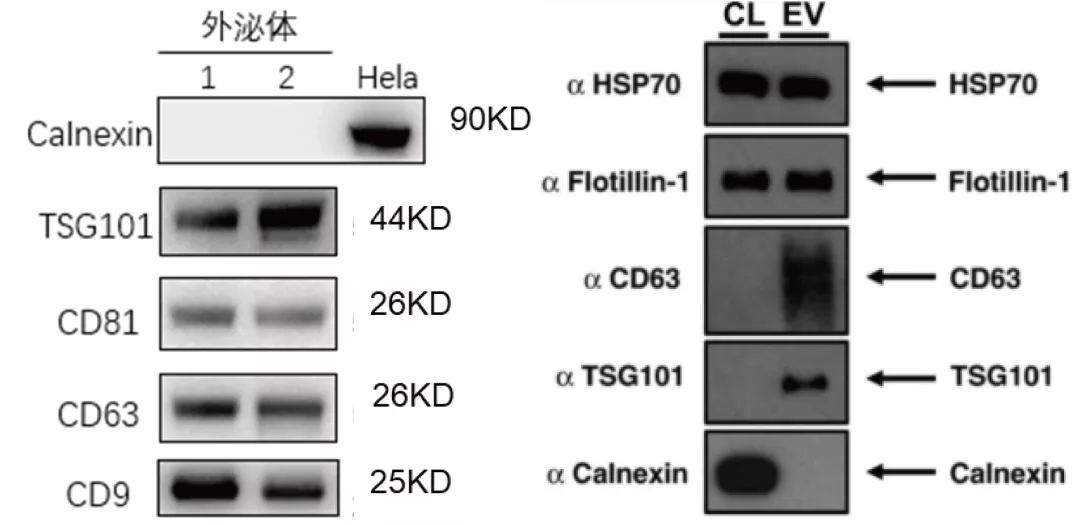
与文献[4]中的WB检测结果(右图)相比都可检出TSG101、CD63条带、阴性对照均无条带。
粒径分析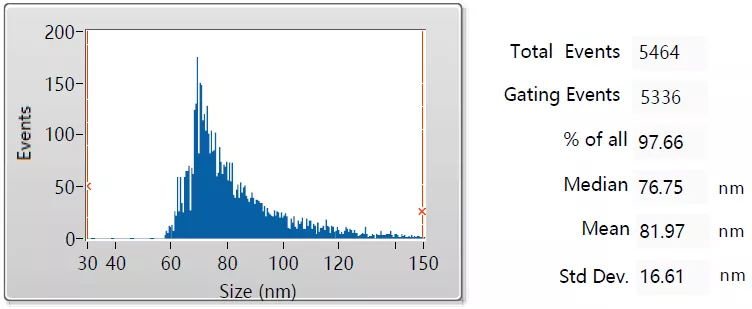
外泌体粒径在30 ~ 200 nm之间,上图可见提取的外泌体平均粒径为81.97nm
结果示例
案例一:研究尼古丁诱导巨噬细胞分泌的外泌体中是否会产生导致动脉粥样硬化的miRNA[5]
文献摘要:在动脉粥样硬化的发展过程中,巨噬细胞分泌调节血管平滑肌细胞(VSMC)的外泌体;但是,香烟中的主要成分尼古丁是否可以在动脉粥样硬化发生的背景下调节仍有待进一步研究。在这项研究中,我们假设尼古丁会诱导巨噬细胞分泌含致动脉粥样硬化的外泌体,其中包含microRNA(miRNA)来介导细胞间串扰并促进VSMC的致动脉粥样硬化表型。
下图是外泌体中miRNA富集后的分析结果。A图显示M-Exos(对照组)和NM-Exos(处理组)中独特和重叠的miRNA。B图显示M-Exos和NM-Exos的差异基因,红色为上调,蓝色为下调。C图用qRT-PCR验证前六个与M-Exos相比,NM-Exos中上调的基因所增加的量。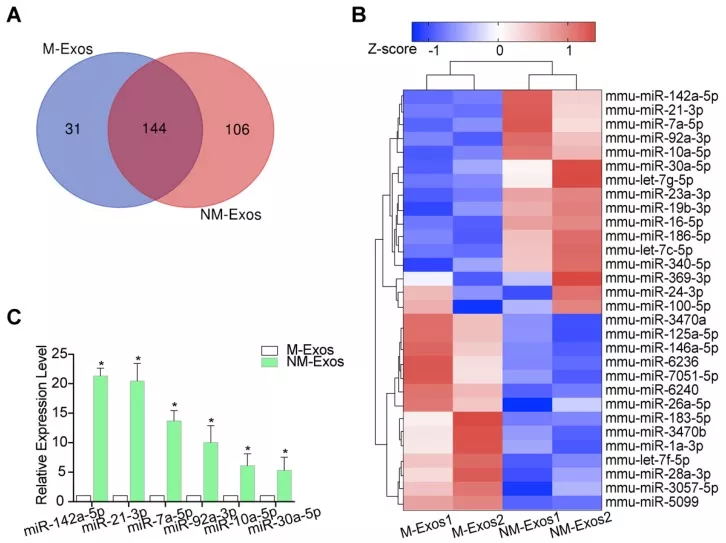
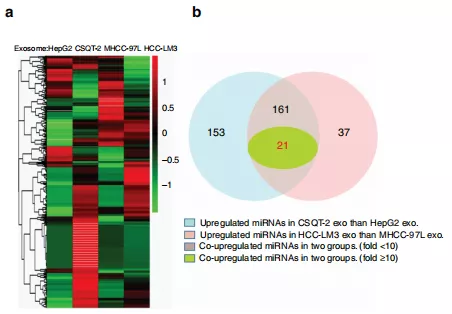
案例二:四种肝癌细胞(两组)中的外泌体miRNA,并进行组间对比。[6]
文章摘要:肿瘤衍生因子与转移微环境中的间质之间的联系在促进肿瘤转移中起着关键作用。然而,肿瘤细胞用来控制转移的转移微环境形成的机制还不完全清楚。在此,我们报道了在肺转移的转移微环境中,高转移肝癌细胞(HCC)比低转移肝癌细胞(HCC)表现出更强的将正常成纤维细胞转化为肿瘤相关成纤维细胞(CAF)的能力。我们发现高转移肝癌细胞分泌miR-1247-3p,直接针对B4GALT3,导致成纤维细胞中β1-整合素-NF-κB信号的激活。激活的CAF通过分泌包括IL-6和IL-8在内的促炎细胞因子进一步促进癌症进展。临床资料显示,肝癌患者血清miR-1247-3p水平升高与肺转移有关。这些结果表明,肿瘤细胞和成纤维细胞之间的细胞间串扰是由肿瘤来源的外泌体介导的,它控制着肝癌的肺转移,为预防和治疗癌症转移提供了潜在的靶点。
取四种肝癌细胞:CSQT-2和HepG2、HCC-LM3和MHCC-97L分为两组。
下图中,图a为四种肝癌细胞的miRNA表达谱。图b为两组细胞中上调的miRNA绘制的韦恩图。例如蓝色的部分代表着与HepG2相比CSQT-2上调的miRNA;绿色代表着两组共同上调的miRNA,并且fold≥10。